Γ΄ ΛΥΚΕΙΟΥ
Στη σελίδα αυτή θα βρείτε κριτήρια αξιολόγησης, φύλλα εργασίας και άλλο υλικό.
(Η αρίθμηση των κεφαλαίων είναι με τη σειρά που διδάχθηκαν κι όχι με αυτή του βιβλίου. Στο τέλος θα βρείτε μια επιπλέον 9η ενότητα με επαναληπτικά διαγωνίσματα)
3η ενότητα
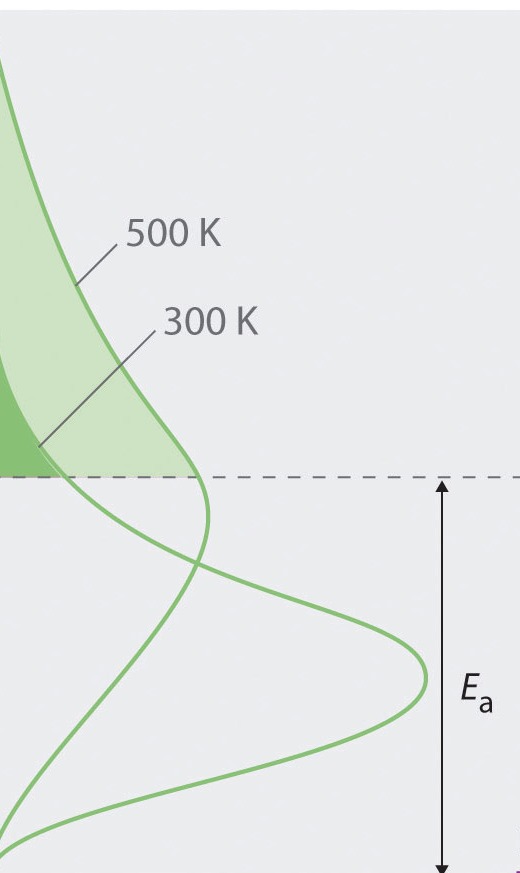
Χημική Κινητική
4η ενότητα
Χημική ισορροπία
Επίδραση της θερμοκρασίας
στην ισορροπία:N2O4(g) ⇄
2 NO2(g) , ΔH > 0
Το NO2 είναι καφέ ενώ το N2O4 άχρωμο. Οπότε η όποια μετατόπιση της ισορροπίας συνοδεύεται και από χρωματική αλλαγή.
Η πιο πάνω αντίδραση είναι ενδόθερμη, οπότε με αύξηση της θερμοκρασίας η ισορροπία μετατοπίζεται δεξιά και το δοχείο χρωματίζεται καφέ, ενώ με ψύξη η ισορροπία μετατοπίζεται αριστερά και το δοχείο αποχρωματίζεται.
Στο βίντεο παρατηρούμε την επίδραση της θερμοκρασίας στην πιο πάνω ισορροπία.
Στο φιαλίδιο υπάρχει σε ισορροπία διοξείδιο του αζώτου και τετροξείδιο του διαζώτου.
Όταν βυθίζουμε το φιαλίδιο στο θερμό υδρόλουτρο χρωματίζεται καφέ, ενώ όταν το βυθίζουμε στο παγόλουτρο αποχρωματίζεται.
Επίδραση της θερμοκρασίας στην ισορροπία:
CuSO4 + 4NaCℓ ⇄ Na2[CuCℓ4] + Na2SO4
Copper sulfate react with sodium chloride to produce tetrachloridocuprate(II) sodium and sodium sulfate.
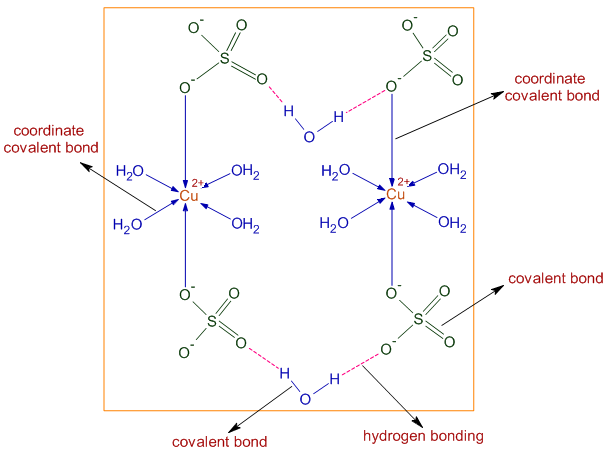
Ο άνυδρος θειικός χαλκός είναι λευκός, ενώ ο ένυδρος θειικός χαλκός είναι μπλε γνωστός ως γαλαζόπετρα. Στη στερεή κατάσταση ο θειικός χαλκός συγκρυσταλώνεται με 5 μόρια νερού σε μια οκταεδρική δομή.
Αναλόγως της συγκέντρωσης του νερού η ισορροπία μετατοπίζεται αριστερά ΄ή δεξιά. Έτσι σε συνθήκες ξηρασίας επικρατεί η άνυδρη μορφή και ο θειικός χαλκός χρωματίζεται άσπρος, ενώ όταν υπάρχει αρκετή υγρασία επικρατεί η ένυδρη μορφή και ο θειικός χαλκός χρωματίζεται μπλε.
CuSO₄ + 5 H₂O ⇄ CuSO₄ ∙ 5 H₂O
Αν διαλύσουμε θειικό χαλκό στο νερό λόγω περίσσειας νερού υπερισχύει η ένυδρη μορφή [Cu(H2O)6]²⁺ η οποία έχει δομή οκταέδρου και το διάλυμα θα χρωματιστεί κυανό.
Αν στο ίδιο διάλυμα διαλύσουμε και χλωριούχο νάτριο, τότε το κατιόν του χαλκού ενώνεται με τα χλωριούχα ανιόντα και δίνει τετραχλωριούχο χαλκό (II) ανιόν [CuCℓ₄]²⁻ με τετραεδρική δομή πράσινου χρώματος.
Η μορφή που θα επικρατήσει και το χρώμα που θα αποκτήσει το διάλυμα εξαρτάτε από την θέση της ισορροπίας.
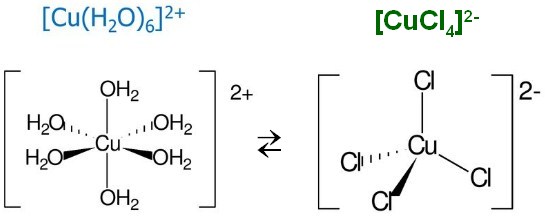
Η παραπάνω αντίδραση είναι ενδόθερμη προς τα δεξιά. Οπότε με θέρμανση η ισορροπία μετατοπίζεται προς τα δεξιά και το διάλυμα χρωματίζεται πράσινο ενώ με ψύξη η ισορροπία μετατοπίζεται προς τα αριστερά και το διάλυμα αποκτά κυανό χρώμα.
Παρόμοια ισορροπία μεταξύ ένυδρης και άνυδρης μορφής έχουμε με το χλωριούχο άλας του κοβαλτίου (II). Το ένυδρο χλωριούχο κοβάλτιο έχει κόκκινο χρώμα ενώ το άνυδρο χλωριούχο κοβάλτιο έχει μπλε χρώμα. Αναλόγως της ποσότητας του νερού μετατοπίζεται η ισορροπία μεταξύ ένυδρης και άνυδρης μορφής με αποτέλεσμα να αλλάζει το χρώμα του άλατος.
CoCl2(s) + 6 H2O(ℓ) ⇄ CoCl2 ∙ 6 H2O(s)
Παρουσία υδρατμών μετατοπίζεται η ισορροπία δεξιά με αποτέλεσμα να αλλάξει το χρώμα του άλατος από μπλε σε κόκκινο, ενώ σε συνθήκες ξηρασίας η ισορροπία μετατοπίζεται αριστερά και το άλας αποκτά και πάλι μπλε χρώμα.
Ένας άλλος παράγοντας που μπορεί να καθορίσει την θέση της ισορροπίας είναι η θερμοκρασία. Σε υδατικό διάλυμα του χλωριούχου κοβαλτίου έχουμε σε ισορροπία τετραχλωριούχο κοβάλτιο (II) ανιόν [CoCl₄]²⁻ μπλε χρώματος με εξαένυδρο κοβάλτιο (II) κατιόν [Co(H₂O)₆]²⁺ ρόδινου χρώματος.
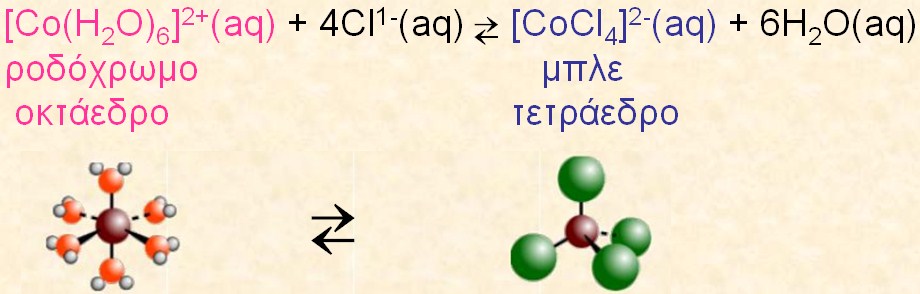
Η παραπάνω αντίδραση είναι ενδόθερμη προς τα δεξιά. Οπότε με θέρμανση η ισορροπία μετατοπίζεται προς τα δεξιά και το διάλυμα χρωματίζεται μπλε ενώ με ψύξη η ισορροπία μετατοπίζεται προς τα αριστερά και το διάλυμα αποκτά ρόδινο χρώμα.
Στο βίντεο παρατηρούμε την επίδραση της συγκέντρωσης των χλωριούχων ανιόντων καθώς επίσης της θερμοκρασίας ως προς τη θέση της πιο πάνω ισορροπίας.
Με την προσθήκη υδροχλωρικού οξέος η ισορροπία μετατοπίζεται δεξιά ώστε να καταναλωθούν τα χλωριούχα ανιόντα και το διάλυμα χρωματίζεται μπλε.
Με την προσθήκη νιτρικού αργύρου σχηματίζεται ο δυσδιάλυτος χλωριούχος άργυρος και η ισορροπία μετατοπίζεται αριστερά ώστε να αναπληρωθούν τα χλωριούχα ανιόντα.
Με την θέρμανση η ισορροπία μετατοπίζεται δεξιά δηλαδή προς την ενδόθερμη φορά και το διάλυμα χρωματίζεται μπλε, ενώ με την ψύξη η ισορροπία μετατοπίζεται αριστερά δηλαδή προς την εξώθερμη φορά και το διάλυμα χρωματίζεται ρόδινο.
Για τη συμπλήρωση του παρακάτω σταυρολέξου χρησιμοποιήστε μικρά ελληνικά γράμματα, σωστή ορθογραφία και τονισμένες τις λέξεις.
Αν η λέξη που θα γράψετε είναι σωστή θα βάλει πράσινο τσεκ μπροστά από την αντίστοιχη ερώτηση, καθώς επίσης θα χρωματίσει με πράσινο τα γράμματα της λέξης.
Η επιλογή κάποιας ερώτησης μπορεί να γίνει είτε με κλικ στην ερώτηση αυτή είτε με κλικ στο αρχίγραμμά της μέσα στο σταυρόλεξο. Αν στο ίδιο τετραγωνάκι που κλικάρετε διασταυρώνεται και δεύτερη λέξη, αρχικά θα επιλεγεί η οριζόντια, για να επιλέξετε την κάθετη λέξη, απλά κλικάρετε στο ίδιο τετραγωνάκι άλλη μια φορά.
5η ενότητα
Οξέα Βάσεις Ιοντική ισορροπία
6η ενότητα
Ηλεκτρονιακή δομή των ατόμων και περιοδικός πίνακας
7η ενότητα
8η ενότητα
Οργανική χημεία
Εργαστηριακή Άσκηση Διάκρισης